Carbon and Its Compounds Class 10 Notes in Hindi – कार्बन एवं उसके यौगिक नोट्स कक्षा 10
Carbon Compounds Class 10 Notes in Hindi – कार्बन एवं उसके यौगिक नोट्स कक्षा 10, Carbon and its Compounds Class 10 Handwritten Notes, Carbon and its Compounds Class 10 Notes NCERT, Class 10 carbon and its Compounds PDF
इस आर्टिकल के अंतर्गत, कक्षा 10 कार्बन और उसके यौगिक नामक अध्याय का संपूर्ण अध्ययन करेंगे। इससे पहले हमने ‘रसायनिक अभिक्रिया एवं समीकरण’ और ‘अम्ल एवं लवण’ तथा ‘धातु और अधातु’ नामक 3 अध्याय का संपूर्ण अध्ययन कर लिया है और उनसे संबंधित कुछ महत्वपूर्ण प्रश्नों को भी।

नमस्कार दोस्तों स्वागत है आप सभी का, एक नई पोस्ट में, इस पोस्ट में हम लोग कक्षा-10वी के अध्याय-4 जिसका नामकार्बन और उसके यौगिक है, को देखने वाले हैं। इस पोस्ट में हम लोग इस अध्याय के सभी महत्वपूर्ण Topics तथा परीक्षा उपयोगी प्रश्नों को भी देखेंगे। जो कि आप नीचे देख सकते हैं-
Read also :
Carbon and its Compounds Class 10 Handwritten Notes in Hindi
मानव सभ्यता के उदय काल से ही मनुष्य और रासायनिक यौगिकों का संबंध रहा है। पश्चिमी सभ्यता में रासायनिक पदार्थों का अध्ययन करने वाले विशेषज्ञों को कीमियागीर कहा जाता था। मानव के विकास एवं वैज्ञानिक विकास के साथ-साथ नए-नए रसायनिक युवकों की खोज भी बढ़ते गए जिसे अध्ययन करना कठिन होता गया। इस कठिनाई को दूर करने के लिए रसायनज्ञ निकोलस लेमोरी ने पदार्थों के वर्गीकरण की शुरुआत की। उन्होंने पदार्थ की प्राप्ति के आधार पर इन्हें 3 वर्गों में विभाजित किया।
- खनिज पदार्थ : ये जमीन से प्राप्त किए जाते हैं जैसे- लोहा, सोना, नमक आदि।
- वनस्पति पदार्थ : ये वनस्पतियों (पेड़-पौधों) से प्राप्त किए जाते हैं जैसे- रबर, गोंद, सिरका, प्रोटीन आदि।
- जंतु पदार्थ : ये पदार्थ जंतुओं से प्राप्त होते हैं जैसे- यूरिया, हीमोग्लोबिन, वसा आदि।
कुछ वैज्ञानिकों ने पदार्थों को दो वर्गों में बाटा है-
- कार्बनिक (Organic)
- अकार्बनिक (Inorganic)
कार्बन (Carbon)
कारबन नाम लैटिन शब्द ‘कार्बो’ से उत्पत्ति हुआ है जिसका अर्थ ‘कोयला’ होता है। यह पृथ्वी पर जीवन की विद्या मानता के लिए, ऑक्सीजन तथा हाइड्रोजन के बाद तीसरा सबसे महत्वपूर्ण तत्व माना गया है।
भूपर्पटी तथा वायुमंडल में अत्यंत अल्प मात्रा में कार्बन उपस्थित है। भूपर्पटी में खनिजों (जैसे- कार्बोनेट, हाइड्रोजन कार्बोनेट, कोयला एवं पेट्रोलियम) के रूप में केवल 0.02% कार्बन उपस्थित हैं तथा वायुमंडल में 0.03% कार्बन डाइऑक्साइड उपस्थित है। प्रकृति में इतनी अल्प मात्रा में कार्बन उपस्थित होने के बावजूद कार्बन का अत्यधिक महत्व है।
कार्बन परमाणु के लक्षण (Characteristics of Carbon Atom)
Carbon परमाणु के लक्षण निम्नलिखित हैं-
- कार्बन आवर्त सारणी के चतुर्थ समूह (या P-ब्लाक) में पाई जाती है। इसका परमाणु क्रमांक 6 है। कार्बन की संयोजकता 4 होती है।
- कार्बन परमाणु की आयनन ऊर्जा अधिक है। इसलिए इलेक्ट्रॉनों को ग्रहण करने या त्यागने की प्रवृत्ति नहीं रखता है बल्कि या अन्य परमाणु के साथ इलेक्ट्रॉनों की साझेदारी करने की प्रवृत्ति रखता है।
- कार्बन की विद्युत ऋणात्मकता 2.5 है, इसलिए हाइड्रोजन के साथ संयोजक बंध बनाता है, क्योंकि हाइड्रोजन की विद्युत ऋणात्मकता 2.1 है।
- कार्बन की चारों संयोजकता एक समतल में समान रूप से 90 अंश के कोण पर स्थित नहीं होती हैं।
कार्बन में सहसंयोजी आबंध (Covalent Bond in Carbon)
वह बंध, जो समान परमाणुओ या भिन्न परमाणुओ के मध्य इलेक्ट्रॉन युग्म के साझे से बनते हैं, सहसंयोजक बंध का लाते हैं।
कार्बन का परमाणु क्रमांक 6 होता है तथा इलेक्ट्रॉनिक विन्यास = 2,4
अर्थात इसके बाइट अंकुश में चार इलेक्ट्रॉन होते हैं एवं इसका अष्टक नियम दो प्रकार से पूर्ण किया जा सकते हैं।
- यह चार इलेक्ट्रॉन खोकर C⁴⁺ धनायन बना सकता है। लेकिन यह संभव नहीं है क्योंकि चार इलेक्ट्रान को खोने में कार्बन को ज्यादा ऊर्जा की आवश्यकता होगी।
- यह चार इलेक्ट्रॉन प्राप्त कर C⁴⁻ ऋणायन बना सकता है। लेकिन इसके लिए कार्बन कुछ चार अतिरिक्त इलेक्ट्रान धारण करना होगा जो की बहुत ही कठिन है।
इस समस्या को हल करने के लिए कार्बन, इसके संयोजी इलेक्ट्रॉनों का कार्बन के अन्य परमाणु या दूसरे तत्वों के परमाणु के साथ साझा कर लेता है।
कार्बनिक यौगिकों के गुणधर्म (Properties of Organic Compounds)
कार्बनिक यौगिकों के गुणधर्म निम्नलिखित हैं
- अधिकांश कार्बन यौगिक अच्छे विद्युत चालक नहीं होते हैं।
- कार्बनिक यौगिकों के गलनांक तथा क्वथनांक बहुत कम होते हैं क्योंकि उनके अणुओ के बीच आकर्षण बल प्रबल नहीं होता है।
एकल सहसंयोजक बंध के उदाहरण
एकल सहसंयोजक बंध के उदाहरण निम्नलिखित हैं-
1.H₂ अणु का बनाना :
हाइड्रोजन परमाणु की संख्या = 1
हाइड्रोजन परमाणु की इलेक्ट्रॉनिक विन्यास = 1
इसके K-कोश में एक इलेक्ट्रॉन है तथा स्कूल को पूर्ण भरने के लिए एक अतिरिक्त इलेक्ट्रान की आवश्यकता होगी। अतः दो हाइड्रोजन परमाणु संयोजी इलेक्ट्रॉनों की साझेदारी करके एक कल सहसंयोजक बंध बनाते हैं।
- H + H• → H : H या H – H
2.H₂O अणु का बनाना :
ऑक्सीजन का परमाणु क्रमांक = 8
इलेक्ट्रॉनिक विन्यास = 2,6
हाइड्रोजन का परमाणु क्रमांक = 1
इलेक्ट्रॉनिक विन्यास = 1
हाइड्रोजन परमाणु का 1 तथा ऑक्सीजन परमाणु के 6 संयोजी इलेक्ट्रॉन होते हैं। ऑक्सीजन परमाणु दो हाइड्रोजन परमाणु के साथ सह-संयोजक बंध बनाता है।
द्वि – सहसंयोजक बंध के उदाहरण
द्वि – सहसंयोजक बंध के उदाहरण निम्नलिखित हैं-
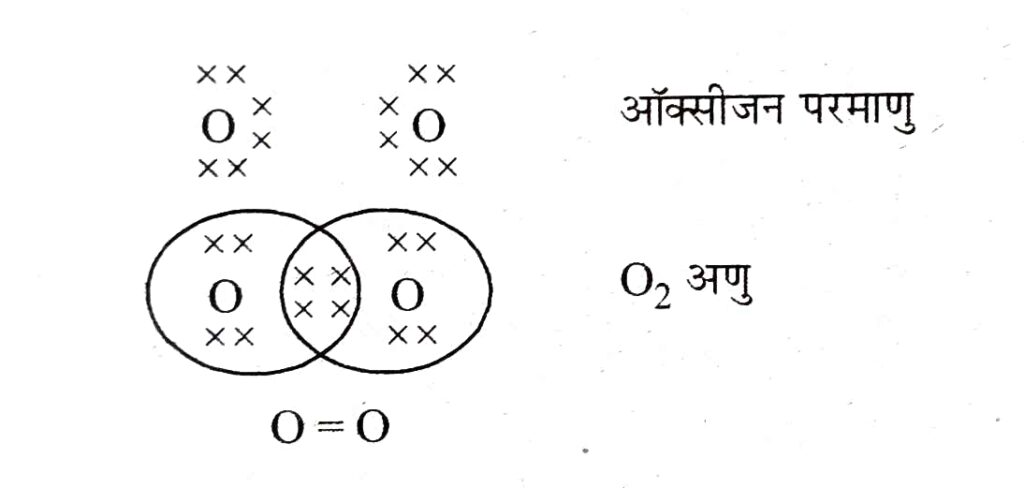
O₂ का बनना :
ऑक्सीजन का परमाणु क्रमांक = 8
इलेक्ट्रॉनिक विन्यास = 2,6
ऑक्सीजन को अपना अष्टक पूरा करने के लिए 2 अतिरिक्त इलेक्ट्रॉनों की आवश्यकता है। इसके लिए जो ऑक्सीजन परमाणु दूसरे ऑक्सीजन परमाणु के साथ दो इलेक्ट्रॉनों की साझेदारी करके आज तक पूरा करते हैं।
त्रि – सहसंयोजक बंध के उदाहरण
त्रि – सहसंयोजक बंध के उदाहरण निम्नलिखित हैं –
N₂ अणु का बनाना :
नाइट्रोजन का परमाणु क्रमांक = 7
इलेक्ट्रॉनिक विन्यास = 2,5
नाइट्रोजन परमाणु को अपना अष्टक पूरा करने के लिए 3 अतिरिक्त इलेक्टरों की आवश्यकता है। अतः प्रत्येक नाइट्रोजन परमाणु अन्य नाइट्रोजन परमाणु से साझेदारी करके आज तक पूरा कर लेते हैं।

सहसंयोजक योगिक ओं की विशेषताएं (Characteristics of Covalent Compound)
सहसंयोजक योगिकओं की विशेषताएं निम्नलिखित हैं-
- सह संयोजी यौगिकों के अणुओं के मध्य वन्डरवाल्स बल होता है जो बहुत कमजोर बल हैं, इस कारण यह गैसीय द्रव अवस्था में पाए जाते हैं। कुछ योगिक जिनके अणुभार को उच्च होते हैं, वे मुलायम ठोस के रूप में पाए जाते हैं।
- सहसंयोजक यौगिकओ के गलनांक और क्वथनांक विद्युत संयोजी यौगिकों की अपेक्षा कम होते हैं, क्योंकि इनके अणुओ के मध्य आकर्षण बल कम होता है।
- सहसंयोजी यौगिक जल में अविलेय होता है तथा ध्रुवीय विलायक को जैसे- बेंजीन आदि कार्बनिक विलायकों में विलेय होते हैं।
- सहसंयोजक यौगिक इलेक्ट्रॉनों की साझेदारी से बने होते हैं। इस कारण इनका आयनन नहीं होता है। आयनन न होने के कारण यह विद्युत धारा के कुचालक होते हैं।
- सहसंयोजक योगिक अधिकतर वाष्पशील होते हैं।
कार्बन के अपरूप (Allotropes of Carbon)
प्रकृति में कार्बन तत्व विभिन्न भौतिक गुणों के साथ अनेक रूपों में पाया जाता है। जब प्रकृति में कोई तत्व विभिन्न रूपों में पाया जाता है जिनके भौतिक गुण भिन्न-भिन्न होते हैं किंतु रसायनिक गुण समान या पराय: समान होते हैं तो इन रूपों को उस तत्वों के अपरूप कहते हैं।
कार्बन विभिन्न रूपों के रूप में पाया जाता है, जिसमें से कुछ निम्नलिखित दिए गए हैं-
- क्रिस्टलीय रूप में, उदाहरण- हीरा ग्रेफाइट तथा फुलेरीन
- सुषमा क्रिस्टलीय रूप या एर्मफस रूप में, उदाहरण- कोयला, लांपब्लैक तथा चारकोल
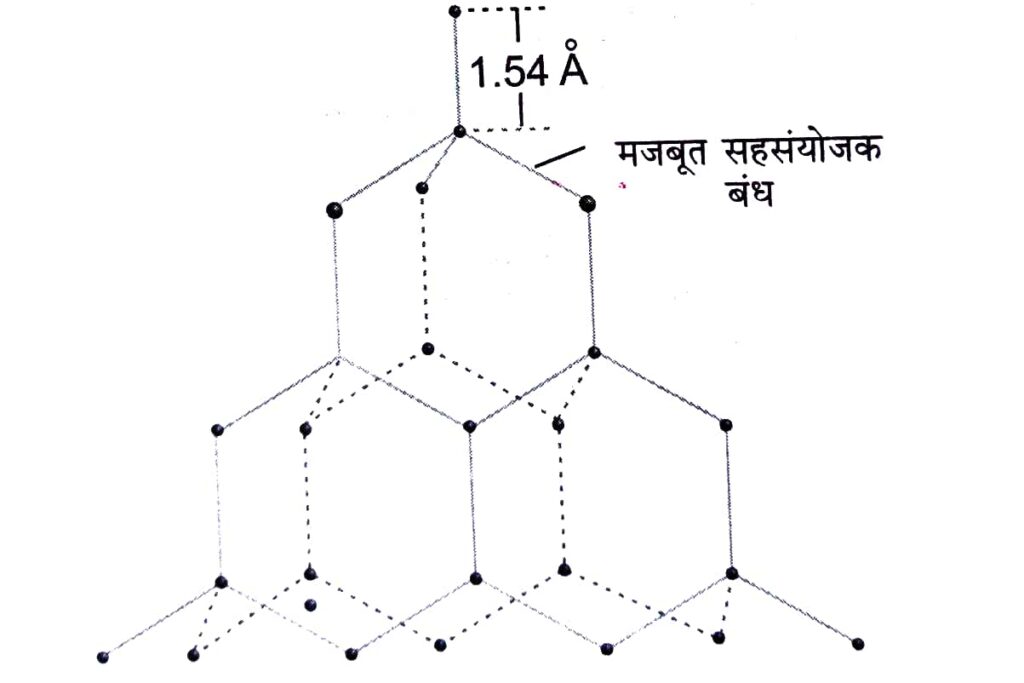
हीरा (Dimond)
यह काफी भारी तथा अत्यधिक कठोर एक रंगहीन पारदर्शी चमकीला पदार्थ होता है। इसकी अत्यधिक चमक उच्च पर तनाव के कारण होती है। इसमें मुक्त इलेक्ट्रॉन की अनुपस्थिति होने के कारण या विद्युत का कुचालक होता है, परंतु इसकी उचित तापीय चालकता तथा उच्च गलनांक बिंदु होता है।
संरचना
यह कार्बन परमाणु का वृहद अणु है, जिसमें प्रत्येक कार्बन परमाणु अन्य चार कार्बन परमाणुओ से प्रबल सहसंयोजक बंध द्वारा जुड़ा होता है। प्रबल सहसंयोजक बंध बनने के कारण इसकी कठोर त्रिविमीय जालक संरचना होती है। हीरे की क्रिस्टल में प्रबल सहसंयोजक बंध को तोड़ने के लिए अत्यधिक ऊर्जा की आवश्यकता होती है।
उपयोग (Uses)
हीरा के निम्नलिखित उपयोग है-
- यह बहुमूल्य आभूषण के रूप में उपयोग किया जाता है।
- इसकी कठोरता के कारण इसका प्रयोग मार्बल ग्रेनाइट तथा ग्लास को काटने वाले चाकू में करते हैं।
ग्रेफाइट (Graphite)
ग्रेफाइट भूरा काला, पारभासी, हीरे से हल्का, मुलायम, चिकना तथा फिसलनशील पदार्थ होता है। या विद्युत का अच्छा चालक होता है क्योंकि इसमें मुक्त इलेक्ट्रॉन की उपस्थिति होती है लेकिन यह उष्मा का अच्छा चालक नहीं होता है।
संरचना
ग्रेफाइट में कार्बन के प्रत्येक परमाणु का बंधन कार्बन के तीन अन्य परमाणु के साथ एक ही ताल पर होता है। जिसके शर्ट कोरिया व्यूह मिलता है। इनमें से एक आबंध द्वि-आबन्धी होता है जिसके कारण कार्बन की संयोजकता पूर्ण होती है। ग्रेफाइट की संरचना में षट्कोणीय तल एक दूसरे के ऊपर व्यवस्थित होते हैं।
उपयोग (Uses)
ग्रेफाइट के निम्नलिखित उपयोग है-
- इसके चूर्ण का प्रयोग मशीनों के पुर्जे में स्नेहक के रूप में होता है।
- इसका प्रयोग शेरों के इलेक्ट्रोड तथा पेंसिल के लिए लेड के रूप में होता है।
फुलेरीन (Fullerene)
फुलरिंग कार्बन अपरूपण का अन्य वर्ग है। सबसे पहले C-60 की पहचान की गई, जिसमें कार्बन की परमाणु फुटबॉल के रूप में व्यवस्थित होते हैं। चुकी यह अमेरिकी आर्किटेक्ट बंकमिंस्टर फूलर द्वारा डिजाइन किए गए जिओडेसिक गुंबद के सामान लगते हैं इसलिए इस अणु को फुलेरीन नाम दिया गया।
कार्बन की सर्वतोमुखी प्रकृति (Versatile Nature of Carbon)
कार्बन में पाए जाने वाले तीन विशिष्ट लक्षणों, श्रृंखलन, कार्बन की चतु: संयोजकता और राहुल बंद बनाने की प्रवृत्ति से बड़ी संख्या में यौगिकों का निर्माण होता है।
- श्रृंखलन (Catenation) : कार्बन में कार्बन की ही अन्य परमाणु के साथ आबंध बनाने की अद्वितीय क्षमता होती है जिससे बड़ी संख्या में अणु बनते हैं। वह। इस गुण को श्रृंखलन कहते हैं।
- कार्बन की संयोजकता (Valency of Carbon) : कार्बन का परमाणु क्रमांक 6 है। इस का इलेक्ट्रॉनिक विन्यास 2,4 है। इसके बाह्यतम कोश में 4 इलेक्ट्रॉन होते हैं। ये चार इलेक्ट्रान 4 सहसंयोजक बंध बनाने में प्रयुक्त होते हैं तथा कार्बन की संयोजकता 4 होती है।
- बहुल आबंध बनाने की क्षमता (Capability of Forming Multiple Bonds) : कार्बन परमाणु के छोटे आकार के कारण इसमें बहुल बंध बनाने की प्रबल प्रवृत्ति होती है। ये स्वयं से या अन्य तत्वों से जैसे ऑक्सीजन, नाइट्रोजन, सल्फर इत्यादि से एक या अधिक इलेक्ट्रान युग्म के साझे द्वारा बंध बना सकते हैं।
जैवशक्ति सिद्धांत (Vital Force Theory)
सन 18 से 15 तक जी धारियों से प्राप्त होने वाली किसी भी पदार्थ को प्रयोगशाला में नहीं बनाया जा सकता था। जबकि अन्य स्रोतों से प्राप्त होने वाले लगभग सभी पदार्थों प्रयोगशाला में बनाया जा सकता था। इस आधार पर वर्जिनियस ने जीव धारियों में एक रहस्यमयी जीवन शक्ति होने की कल्पना की। उन्होंने इस शक्ति को जैव शक्ति का नाम दिया।
वर्जिनियस के जैवशक्ति सिद्धांत के अवधारणा अनुसार कार्बनिक यौगिकों के निर्माण के लिए जेब शक्ति की उपस्थिति होना अनिवार्य है।
जैवशक्ति सिद्धांत का अंत
सन 18 सो 28 में जर्मनी के प्रसिद्ध रसायनज्ञ ह्वोलर ने प्रयोगशाला में अमोनियम सायनेट (इनार्गेनिक पदार्थ) को गर्म करके यूरिया (ऑर्गेनिक पदार्थ) प्राप्त किया। इससे पहले अमोनियम सायनाइड को अमोनिया तथा हाइड्रोजन सायनाइड के सहयोग से प्राप्त कर लिया गया था।
NH₃ + HCN → NH₄CNO
NH₄CNO → NH₂CONH₂
ह्वोलर की खोज से जैवशक्ति सिद्धांत को असत्य प्रमाणित कर दिया गया। इसके बहुत सारे वैज्ञानिकों ने प्रयोगशाला में ऑर्गेनिक पदार्थों का निर्माण किया। इस प्रकार जैवशक्ति सिद्धांत का अंत हो गया।
हाइड्रोकार्बन (Hydrocarbon)
वे यौगिक जिनमें केवल कार्बन और हाइड्रोजन उपस्थित होते हैं, हाइड्रोकार्बन कहलाते हैं। हाइड्रोकार्बन में उपस्थित परमाणुओ की सभी श्रृंखलाएं खुली या बंद हो सकती है।
जैसे-CH₄, C₂H₆ , C₂H₄ आदि।
हाइड्रोकार्बन दो प्रकार के होते हैं-
- एलिफैटिक हाइड्रोकार्बन
- एरोमैटिक हाइड्रोकार्बन
एलिफैटिक हाइड्रोकार्बन (Aliphatic Hydrocarbons)
वे हाइड्रोकार्बन, जिनमें कार्बन परमाणु की खुली विवृत श्रृंखला होती है एलिफैटिक हाइड्रोकार्बन कहलाते हैं।
यह दो भागों में वर्गीकृत किया गया है
- संतृप्त हाइड्रोकार्बन
- असंतृप्त हाइड्रोकार्बन
संतृप्त हाइड्रोकार्बन (Saturated Hydrocarbons)
संतृप्त हाइड्रोकार्बन वे एलिफैटिक हाइड्रोकार्बन है जिनमें कार्बन-कार्बन परमाणु के मध्य एकल बंध होता है तथा प्रत्येक कार्बन की चारों संयोजकताएं एकल बंधो द्वारा संतुष्ट होती है।
उदाहरण- मेथेन(CH₄), एथेन(C₂H₆), प्रोपेन आदि।
संतृप्त हाइड्रोकार्बन के गुण
- ये यौगिक अन्य कार्बनिक यौगिकों की तुलना में कम क्रियाशील होते हैं।
- ये प्रतिस्थापन अभिक्रियाएं देते हैं।
- कम क्रियाशीलता के कारण इन्हें पैराफिन भी कहा जाता है।
संतृप्त हाइड्रोकार्बन दो प्रकार के होते हैं-
- एल्केन (अचक्रीय यौगिक)
- साइक्लो एल्केन (चक्रीय यौगिक)
एल्केन (अचक्रीय यौगिक) के कुछ उदाहरण
इस यौगिक का सामान्य सूत्र CₙH₂ₙ₊₂ होता है तथा ये एक ही सजातीय श्रेणी के सदस्य हैं।
| कार्बन परमाणु की संख्या | नाम | सूत्र | संरचना |
| 1 | मेथेन | CH₄ |  |
| 2 | एथेन | C₂H₆ | 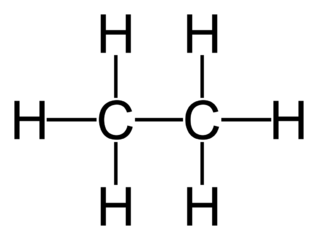 |
| 3 | प्रोपेन | C₃H₈ |  |
| 4 | ब्यूटेन | C₄H₁₀ | 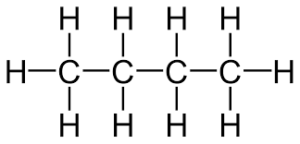 |
| 5 | पेण्टेन | C₅H₁₂ | 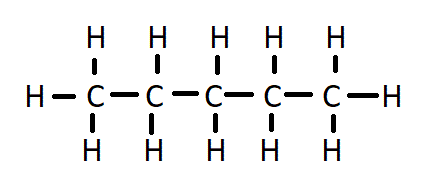 |
साइक्लो एल्केन (चक्रीय यौगिक) के कुछ उदाहरण
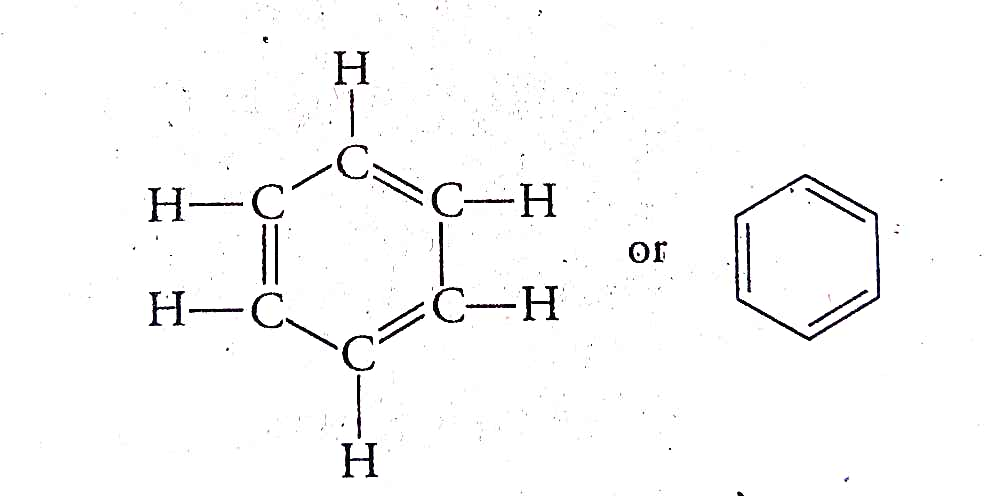
साइक्लोहेक्सीन(C₆H₁₂)
बेंजीन (C₆H₆)
असंतृप्त हाइड्रोकार्बन (Unsaturated Hydrocarbons)
असंतृप्त हाइड्रोकार्बन वे एलिफैटिक हाइड्रोकार्बन है, जिनमें दो कार्बन परमाणु के मध्य एक द्विबन्ध या त्रिबंध उपस्थित होता है तथा प्रत्येक कार्बन की चारों संयोजकताएं एकल बंधो द्वारा पूर्णतया संतुष्ट नहीं होती हैं।
जैसे- एथिलीन(CH₂=CH₂) , एसिटिलीन(CH≡CH) आदि।
असंतृप्त हाइड्रोकार्बन दो प्रकार के होते हैं-
- एल्कीन (द्विबंध युक्त असंतृप्त हाइड्रोकार्बन)
- एल्काइन (त्रिबंध युक्त असंतृप्त हाइड्रोकार्बन)
एल्कीन (द्विबंध युक्त असंतृप्त हाइड्रोकार्बन)
वे असंतृप्त एलिफेटिक हाइड्रोकार्बन जिनमें दो कार्बन परमाणु के मध्य द्विबन्ध उपस्थित होता है, एल्कीन या ओलिफिन कहलाते हैं।
जैसे- एथिलीन(CH₂=CH₂)
एल्कीन के कुछ अन्य उदाहरण
इस श्रेणी के सदस्यों का सामान्य सूत्र CₙH₂ₙ होता है।
| कार्बन परमाणु की संख्या | साधारण नाम | सूत्र | संरचना |
| 1 | मिथाइलीन | CH₂ | |
| 2 | इथाइलीन | C₂H₄ | CH₂ = CH₂ |
| 3 | प्रोपाइलीन | C₃H₆ | CH₃ – CH = CH₂ |
| 4 | ब्यूटाइलीन | C₄H₈ | CH₃ – CH₂ – CH = CH₂ |
| 5 | पेंटाइलीन | C₅H₁₀ | CH₃ – CH₂ – CH = CH – CH₃ |
एल्काइन श्रेणी के कुछ अन्य उदाहरण
इस श्रेणी के सदस्यों का सामान्य सूत्र CₙH₂ₙ₋₂ होता है।
| कार्बन परमाणु की संख्या | नाम | सूत्र | संरचना |
| 1 | _____ | CH₀ | |
| 2 | एसिटिलीन | C₂H₂ | CH ≡ CH |
| 3 | एलिलीन | C₃H₄ | CH₃ – C ≡ CH |
| 4 | ________ | C₄H₆ | CH₃ – CH₂ – C ≡ CH |
| 5 | ________ | C₅H₈ | CH₃ – C ≡ C – CH₂ – CH₃ |
एरोमैटिक हाइड्रोकार्बन
वे हाइड्रोकार्बन, जिनमें कार्बन परमाणु आपस में सिग्मा अथवा पाई बंध के द्वारा बंद विवृत श्रृंखला में विन्यासित होते हैं, एरोमैटिक हाइड्रोकार्बन कहलाते हैं।
समावयवता (Isomerism)
बहुत से कार्बनिक यौगिक के आणविक सूत्र एक ही होते हैं, परंतु उनके संरचना सूत्र भिन्न होते हैं। कार्बनिक यौगिकों की इस घटना को समावयवता कहते हैं। इस प्रकार की यौगिकों को एक दूसरे के समावयवी कहते हैं।
उदाहरण- 4 कार्बन परमाणु (C₄H₁₀) वाले एल्केन (ब्यूटेन) के लिए निम्न दो संरचनात्मक समय संभव है।
क्रियात्मक समूह (Functional Group)
किसी कार्बनिक यौगिक के अणु में उपस्थित वह परमाणु समूह जिस पर यौगीक की लगभग सभी रसायनिक अभिक्रियाएं निर्भर करती है, क्रियात्मक समूह कहलाता है।
सजातीय श्रेणी (Homologous Series)
समान क्रियात्मक समूह वाले कार्बनिक यौगिकों को जब बढ़ते हुए परमाणु भारों या बढ़ते हुए कार्बन संख्या के क्रम में व्यवस्थित किया जाए तो एक श्रेणी प्राप्त होती है जिसे सजातीय श्रेणी कहते हैं। सजातीय श्रेणी का प्रत्येक सदस्य एक दूसरे का सजात कहलाता है।
सजातीय श्रेणी की विशेषताएं (Characteristics of Homologous Series)
Homologous Series के सदस्यों में निम्नलिखित विशेषताएं पाई जाती है।
- किसी सजातीय श्रेणी के सभी सदस्यों को एक सामान्य सूत्र से प्रदर्शित किया जा सकता है।
- किसी सजातीय श्रेणी के सभी सदस्यों को एक जैसी विधियों द्वारा बनाया जा सकता है।
- सजातीय श्रेणी के सदस्यों में प्रत्येक दो निकटतम सदस्यों के मध्य एक निश्चित और उभार का अंतर होता है।
- सजातीय श्रेणी के सदस्यों में उनके भौतिक एवं अधिकांश रासायनिक गुणों में एक क्रमिक वृद्धि या कमी पाई जाती है।
- सजातीय श्रेणी के किन्ही दो क्रमागत सदस्यों में -CH₂ समूह का अंतर होता है।
कार्बनिक यौगिकों का नामकरण : IUPAC पद्धति
IUPAC पद्धति में यौगिकों का नामकरण निम्नलिखित नियमों पर आधारित होता है-
-
मूल शब्द या मुलाक्षर (Root Word)
यह कार्बनिक यौगिकों में कार्बन परमाणुओ की सबसे लंबी श्रृंखला में कार्बन परमाणुओ की संख्या को प्रकट करता है। कार्बनिक योगिक जिस मूल एल्केन का बना होता है उसकी कार्बन परमाणु संख्या के आधार पर उसे नाम दिया जाता है।
| कार्बन परमाणुओ की संख्या | मूल शब्द |
| C₁ | मेथ Meth |
| C₂ | ऐथ Eth |
| C₃ | प्रोप Prop |
| C₄ | ब्यूट Beut |
| C₅ | पेण्ट Pent |
| C₆ | हेक्स Hex |
| C₇ | हेप्ट Hept |
| C₈ | आक्ट Oct |
| C₉ | नान Non |
| C₁₀ | डेक Dec |
-
अनु लग्न (Suffix)
यह दो प्रकार के होते हैं-
(i) प्राइमरी अनुलग्न (Primary Suffix)
यह मूल शब्द के पीछे जोड़ा जाता है तथा कार्बन श्रृंखला में संतृप्तता या असंतृप्तात को प्रकट करता है।
- यौगिक में एकल बंध होने पर ‘ऐन’
- यौगिक में द्विबंध होने पर ‘ईन’
- योगिक त्रिबंध होने पर ‘आईन’ लिखा जाता है।
उदाहरण –
| कार्बन श्रृंखला की प्रकृति | प्राथमिक अनुलग्न | जनक का नाम | उदाहरण |
| एकल बंध ( C-C) | ऐन | एल्केन | (CH₄ ) मेथ + ऐन = मेथेन
(C₂H₆) एथ + ऐन = एथेन |
| द्विबंध (C=C) | ईन | एल्कीन | (CH₂= CH₂) एथ + इन = ऐथीन
(CH₂CH=CH₂) प्रोप + इन = प्रोपीन |
| त्रिबंध (C≡C) | आइन | एल्काइन | (CH≡CH) एथ + आइन = एथाइन
(CH₃-C ≡ CH) प्रोप + आइन = प्रोपाइन |
(ii) द्वितीय अनुलग्न (Secondary Suffix)
यह यौगिक के मुख्य क्रियात्मक समूह का ज्ञान कराता है। इसे आईयूपीएसी पद्धति में सबसे अंत में लिखते हैं। प्रत्येक क्रियात्मक समूह के लिए एक विशेष नाम एवं सूत्र निर्धारित किया गया है।
उदाहरण—
| क्रियात्मक समूह | द्वितीयक अनुलग्न | जनक का नाम | उदाहरण |
| एल्कोहल (-OH) | ऑल | एल्केनाल | CH₃OH मेथेनॉल
C₂H₅OH एथेनॉल |
| एल्डिहाइड (-CHO) | अल | एल्केनल | CJ₃CHO एथेनल
HCHO मेथेनल |
| कीटोन (>C=O) | आन | एल्केनोन | CH₃COCH₃ प्रोपेनॉन |
| हैलाइड (-Cl, -Br ) | हैलाइड | एल्किल हैलाइड | CH₃Cl मेथिल क्लोराइड
C₂H₅Cl एथिल क्लोराइड |
- पूर्वलग्न (Prefix)
पाश्र्व श्रृंखलाओं, परमाणु या परमाणु समूहों जैसे- फ्लोरो(-F), क्लोरो(-Cl), ब्रोमो(-Br), आयोडो(-I), नाइट्रो(NO₂), ऐल्काक्सी(-OR) आदि। जो प्रतिस्थापक माने जाते हैं उनके नाम को मूल शब्द से पहले कार्बन श्रृंखला में इनका अंक बताते हुए लिखा जाता है।
IUPAC पद्धति में मुख्य क्रियात्मक समूह का वरीयता क्रम
क्रियात्मक समूह का वरीयता क्रम निम्न सारणी द्वारा स्पष्ट किया गया है-
एलिफेटिक यौगीको की श्रेणीओ की यौगिकों के IUPAC नाम
| संरचना सूत्र | साधारण नाम | मूल शब्द | प्राथमिक अनुलग्न | द्वितीयक अनुलग्न | IUPAC नाम |
| एल्केन (CₙH₂ₙ₊₂)
CH₄ CH₃CH₃ |
मेथेन
एथेन |
मेथ
ऐथ |
ऐन
ऐंन |
_____
_____ |
मेथेन
एथेन |
| एल्कीन (CₙH₂ₙ)
CH₂= CH₂ CH₃CH= CH₂ |
एथाइलीन
प्रोफाइलीन |
एथ
प्रोप |
ईन
ईन |
_____
______ |
ऐथीन
प्रोपाइन |
| एल्काइन (CₙH₂ₙ₋₂)
CH≡CH CH₃-C ≡ CH |
एसिटिलीन
प्रोपिलीन |
एथ
प्रोप |
आइन
आइन |
________
_______ |
एथाइन
प्रोफाइन |
| एल्कोहल या एल्केनाल
(CₙH₂ₙ₊₁OH) CH₃OH CH₃CH₂OH |
मैथिल एल्कोहल
एथिल एल्कोहल |
मेथ
एथ |
ऐन
ऐन |
आल
आल |
मेथेनॉल
एथेनॉल |
| एल्डिहाइड या एल्केनल
(CₙH₂ₙO) HCHO CH₃CHO |
फॉर्मेल्डिहाइड
एसिटैल्डिहाइड |
मेथ
एथ |
ऐन
ऐन |
अल
अल |
मेथेनल
एथेनल |
| कीटोन या एल्केनोन
(CₙH₂ₙO) CH₃COCH₃ CH₃COC₂H₅ |
एसीटोन
एथिल मेथिल कीटोन |
प्रोप
ब्यूट |
ऐन
ऐन |
ओन
ओन |
प्रोपेनोन
2- ब्यूटेनोन |
| कार्बोक्सिलिक अम्ल या वसीय अम्ल या एल्केनोइक अम्ल
(CₙH₂ₙO₂) HCOOH CH₃COOH |
फार्मिक अम्ल
एसिटिक अम्ल |
मेथ
एथ |
ऐन
ऐन |
ओइक अम्ल
ओइक अम्ल |
मेथेनोइक अम्ल
एथेनोइक अम्ल |
| हैलोएल्केन (CₙH₂ₙ₊₁X)
CH₃Cl C₂H₅Br |
मेथिल क्लोराइड
एथिल ब्रोमाइड |
मेथ
एथ |
ऐन
ऐन |
_____
_____ |
क्लोरोमेथेन
ब्रोमोएथेन |
| एसिड क्लोराइड या एल्केनाइल कोलाइड
(R-CO-Cl) CH₃COCl CH₃CH₂COCl |
एसिटिल क्लोराइड
प्रोपिआनिल क्लोराइड |
एथ
प्रोप |
ऐन
ऐन |
आइल क्लोराइड
आइल क्लोराइड |
एथेनाइल क्लोराइड
प्रोपेनाइल क्लोराइड |
| एसिड एमाइड या एलकेनामाइड (R-CO-NH₂)
HCONH₂ CH₃CONH₂ |
फार्मेमाइड
एसीटैमाइड |
मेथ
एथ |
ऐन
ऐन |
एमाइड
एमाइड |
मेथेनेमाइड
एथेनेमाइड |
| एल्किल एमीन
(R-NH₂) CH₃NH₂ CH₃CH₂NH₂ |
मेथिल एमीन
एथिल एमीन |
मेथ
एथ |
ऐन
ऐन |
एमीन
एमीन |
मेथेनेमीन
एथेनेमीन |
| इथर या एल्काक्सी एल्केन (CₙH₂ₙ₊₂O)
CH₃OCH₃ CH₃CH₂OCH₃ |
डाईमेथिल इथर
एथिल मेथिल इथर |
मेथ
एथ |
ऐन
ऐन |
मेथाक्सी
मेथाक्सी |
मेथाक्सीमेथेन
मेथाक्सीएथेन |
कार्बनिक यौगिकों के रासायनिक गुणधर्म
(Chemical Properties of Carbon Compounds)
कार्बनिक यौगिकों के रासायनिक गुणधर्म निम्नलिखित हैं-
1.दहन (Combustion)
किसी पदार्थ का ऑक्सीजन अथवा वायु की अधिकता में जलना दहन कहलाता है। दहन ऊष्माक्षेपी अभिक्रिया है और ऊष्मा तथा प्रकाश के रूप में प्रचुर मात्रा में ऊर्जा को मुक्त के साथ कार्बन डाइऑक्साइड देते हैं।
C + O₂ → CO₂ + ऊष्मा एवं प्रकाश
CH₄ + 2O₂ → CO₂ + 2H₂O + ऊष्मा एवं प्रकाश
पेट्रोलियम (Petroleum)
पेट्रोलियम का हारे हारे भूरे रंग का गाढा, जल से हल्का, तेरे जैसा चिकना तीक्ष्ण गंध वाला, संतृप्त एलिफेटिक हाइड्रोकार्बन का मिश्रण है। जिस में कार्बन परमाणु की संख्या 1 से 40 तक होती है। पेट्रोलियम में बेंजीन साइक्लोहेक्सीन, क्लोरोफिल, नाइट्रोजन एवं सल्फर युक्त यौगिक अशुद्धियों के रुप में पाए जाते हैं।
इंधन (Fuel)
वे कार्बन यौगिक, जिनमें ऊर्जा संचित होती है तथा ऊष्मा एवं प्रकाश के साथ जलते हैं इंधन कहलाते हैं।
2.आक्सीकरण (Oxidation)
दहन द्वारा अक्सीकरण के अतिरिक्त भी ऐसी अभिक्रिया होती है जिनमें यौगिकों का ऑक्सीकरण किया जाता है। कुछ पदार्थों में अन्य पदार्थों को ऑक्सीजन देने की क्षमता होते इन पदार्थों को ऑक्सीकारक कहा जाता है।
साबुन वह साबुनीकरण
उच्च अणु भार वाले मोनो कार्बोक्सिलिक अम्लो के सोडियम तथा पोटैशियम लवण साबुन कहलाते हैं। यह तेलो और वसाओ के तनु NaOH या तनु KOH द्वारा जल अपघटन से प्राप्त होते हैं।
तेलो और वसाओ के क्षारीय जल अपघटन से साबुन प्राप्त होने की क्रिया को साबुनीकरण कहते हैं।
अच्छे साबुन के गुण (Properties of Standard Soap)
अच्छे तथा उत्तम कोटि के साबुन में निम्नलिखित गुण होने चाहिए-
- इसमें जल की मात्रा 10% से अधिक नहीं होनी चाहिए
- साबुन में क्षार नहीं होना चाहिए क्योंकि क्षार त्वचा तथा वस्त्रो के लिए हानिकारक है।
- साबुन चिकना तथा मुलायम होना चाहिए।
- इसमें कीटाणु नाशक पदार्थ मिले होने चाहिए।
साबुन के प्रकार (Types of Soap)
दैनिक जीवन में साबुन दो प्रकार के होते हैं
- नहाने का साबुन (मृदु साबुन)
- कपड़े धोने का साबुन (कठोर)
साबुन की स्वच्छीकारक क्रिया (Cleansing Action of Soap)
मिसेल (Micelle)
साबुन के अणु ऐसे होते हैं जिनके दोनों सिरों के विभिन्न गुणधर्म होते हैं। जल में विलय एक सिरे को जलरागी कहते हैं तथा हाइड्रोकार्बन में विलय दूसरे सिरोको जलविरागी कहते हैं।
जब साबुन जल की सतह पर होता है तब इसके आणु अपने को इस प्रकार व्यवस्थित कर लेते हैं कि इसका आयनिक शीरा जल के अंदर होता है जबकि हाइड्रोकार्बन पूंछ अर्थात दूसरा छोर जल के बाहर होती है। जल के अंदर इन अणुओ की एक विशेष व्यवस्था होती है जिससे इसका हाइड्रोकार्बन शीरा जल के बाहर बना होता है। ऐसा अणुओं का बड़ा गुच्छा बनने के कारण होता है जिसमें जलविरागी पूछ गुच्छे के आंतरिक हिस्से में होती है जबकि उसका आयनिक सिर्फ गुच्छे की सतह पर होती है। इस संरचना को मिसेल कहते हैं।
FAQs____________
प्रश्न 1-कार्बन के दो गुणधर्म कौन से हैं जिनके कारण हमारे चारों ओर कार्बन यौगिकों की विशाल संख्या दिखाई देती है?
उत्तर- कार्बन यौगिकों की विशाल संख्या के निम्नलिखित दो कारण हैं
- कार्बन परमाणु श्रृंखलन
- कार्बन परमाणु की चतु: संयोजकता
प्रश्न 2-कार्बनिक रसायन को परिभाषित कीजिए।
उत्तर- रसायन विज्ञान की वह शाखा जिसके अंतर्गत कार्बन की यौगिकों का अध्ययन किया जाता है कार्बनिक रसायन कहलाती है।
प्रश्न 3-जैव शक्ति सिद्धांत पर टिप्पणी लिखिए
उत्तर- फ्रांसीसी वैज्ञानिक वर्जिलियस ने बताया कि संसार में समस्त कार्बनिक यौगिकों का निर्माण केवल जीव जंतुओं द्वारा ही होता है। अर्थात जो जगह थी कार्बनिक पदार्थों को प्राप्त करने का एकमात्र साधन है अथवा कार्बनिक यौगिकों के निर्माण के लिए जैव शक्ति की उपस्थिति अनिवार्य है। वर्जिनियस की सावधाना को वर्जिलियस का जैव शक्ति सिद्धांत कहा गया।